
近日,2023年度中国医学人工智能代表性算法评选结果出炉,由浙江大学医学院附属第一医院、阿里巴巴达摩院联合提出的“人体正常器官的分层分割模型”入选其中。该算法可高效分割42个器官,让放疗规划更精准,病人更受益,有效降低放疗对身体的损伤,并帮助医生减轻了90%的靶区勾画工作量。
据悉,中国医学人工智能代表性算法每年评选一次,每年不超过三项,由具有法人资质的单位或相关领域权威专家提名。本次评选由中国生物医学工程学会医学人工智能分会、中国工业与应用数学学会数学与医学交叉学科专业委员会、数学图像联盟组织评审,将于12月底的2023中国医学人工智能大会上颁奖。

放射治疗(RT)是治疗癌症的关键方式之一,其有效性与安全性高度依赖于靶区和危及器官的准确勾画。这要求医生在制定放射治疗规划时,对器官进行精准的分割勾画,最大限度将放射剂量集中在靶区,减少靶区周边的正常器官受到不必要的伤害。
举例来说,在对头颈部(H&N)癌症患者进行放射治疗时,需要限制正常解剖结构受到的辐射剂量,从而减少治疗后的并发症,如:口干、吞咽困难、视力损伤和认知能力下降等。
然而,想要手动精确规划如此多的危及器官(OAR)并非易事,需要耗费大量的临床专业知识和时间——平均在一个病人身上平均要花费3-4小时;不仅耗时耗力,而且容易出错,导致RT的有效性和安全性降低。
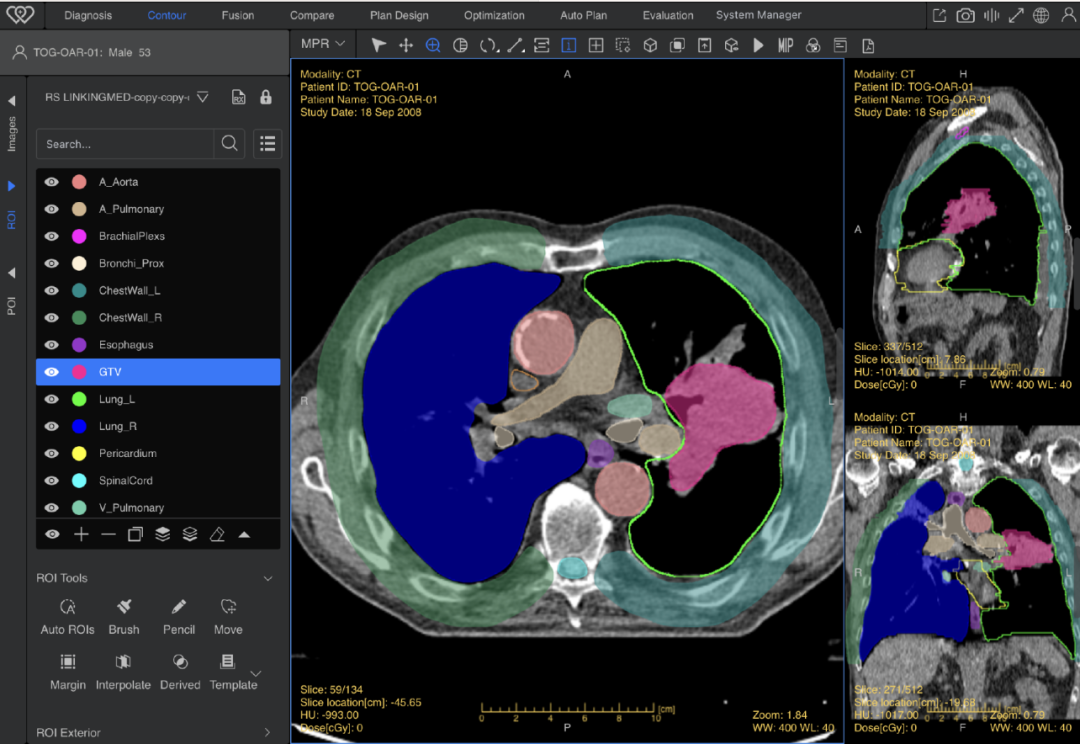
图为AI自动完成的放疗靶区勾画工作,红色为靶区,其他颜色为正常器官
但好消息是,近年来,基于深度学习的自动危及器官分割方法取得了巨大进展,极大地提高了器官分割的精度和效率,给医护人员和癌症患者带去了希望。
2022年10月,国际医学期刊Nature Communications刊登了浙大一院、达摩院联合研究团队提出了危及器官分层分割模型(SOARS)。这个自动化且高效的算法系统SOARS,构建了两个维度的分层深度学习框架,实现42个头颈部OARs的精准分割。
正如文首提及的那样,该算法也斩获了此次“2023年度中国医学人工智能代表性算法”。

doi: 10.1038/s41467-022-33178-z
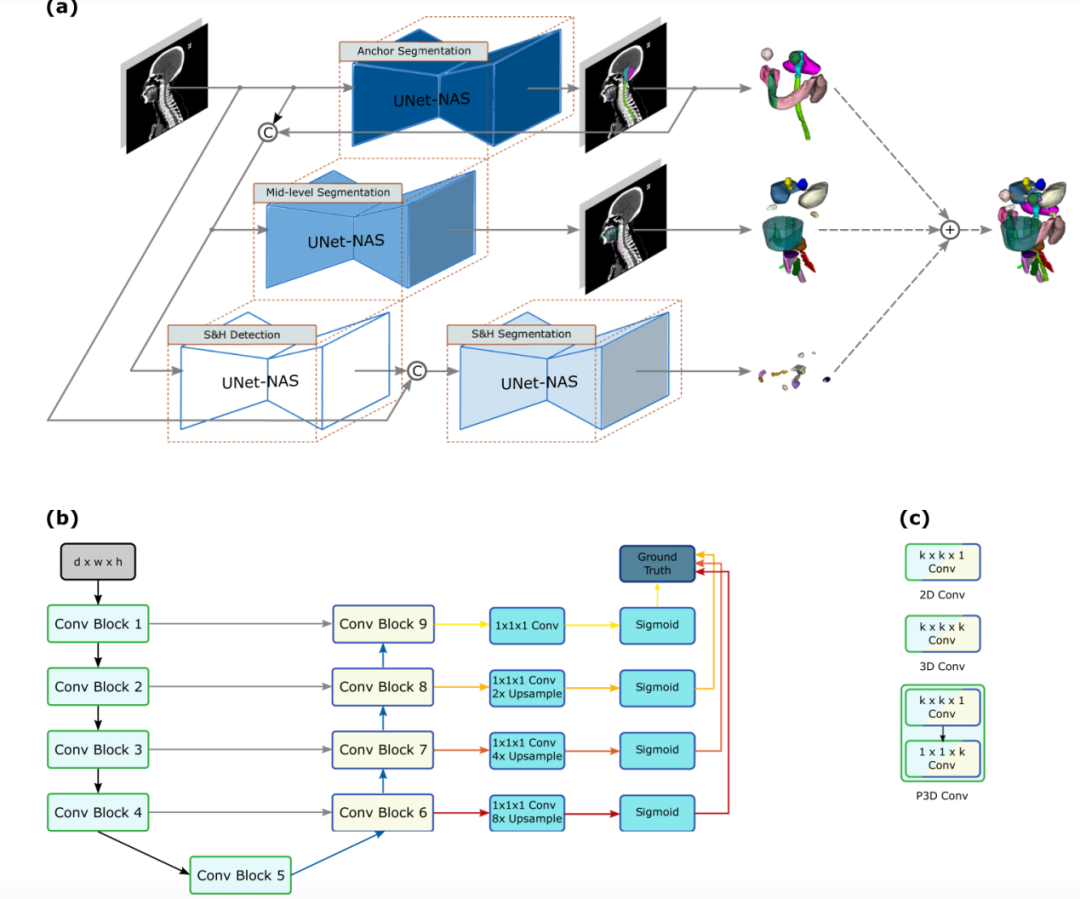
具体来说,分层深度学习框架的搭建分为两个层面。
第一个分层学习是学习过程的分层(Process Stratification)。
为了开发SOARS,研究者采用2015-2018年期间、从中国台湾长庚医院收集到的176名患者数据,创建了培训验证数据集。其中,每个患者都接受了pCT扫描,且均以RT作为主要治疗手段。
根据共识指南或指南推荐的划定方法,拥有专业资质的放射肿瘤科医生手动划定了患者的OAR,每名患者均有42个OARs。值得注意的是,这些资深医生不仅在头颈部肿瘤专业领域有着超过10年的经验,每年治疗的患者人数高达100-300人,同时在临床实践中还非常熟悉和严格遵守共识指南。
SOARS方法
根据分割的难易程度和大小,研究者将头颈部的42个OARs分为3个层次,分别是锚点(Anchor),中级(Mid-level)和小而硬(Small&Hard,S&H)。过程来看,研究者首先分割出简单容易的锚点器官;再利用锚点器官帮助精准定位和分割中级和S&H器官;最后,采用先检测再分割的方式对S&H器官进行处理。
锚点OARs包括9个,分别是脑干、小脑、眼球(左和右)、下颌骨(左和右)、脊髓和颞下颌关节(左和右)。
中级OARs包括19个,分别是臂丛神经(左和右)、基底神经节(左和右)、收缩肌(下、中、上)、食道、声门和声门上喉、声门区、口腔、腮腺(左和右)、下颌下腺(左和右)、大脑颞叶(左和右)、甲状腺(左和右)。
S&H OARs包括14个,分别是耳蜗(左和右)、下丘脑、内耳(左和右)、泪腺(左和右)、晶状体(左和右)、视神经(左和右)、视交叉、松果体和脑下垂体。
上述42个OARs代表了最详细的头颈部OAR集之一,可作为其他机构检测和评估肿瘤患者时的超集(Superset)。此外,研究者还将该数据集进一步分为2组,80%用于训练和验证分割模型,另20%用于评估消融性能。
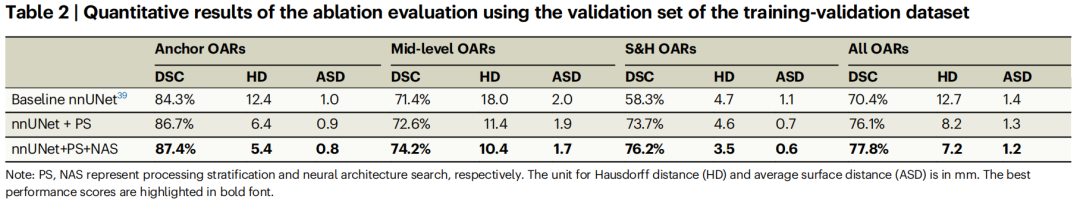
SOARS的消融性能
第二个是分层学习是用自动网络搜索技术(Network Architecture Search)。基于上述3个不同层次的器官组,研究者尝试找到最适合每组的网络结构。
除了培训验证时纳入的176名患者外,研究者还从多个医疗机构(中国台湾长庚医院、西安交通大学第一附属医院、浙江大学医学院第一附属医院等)的回顾性研究中共计收集到1503名头颈部肿瘤患者,从独立内部、多机构外部、多用户、公共头颈部OAR数据集等等多层面来评估SOARS系统的准确性。
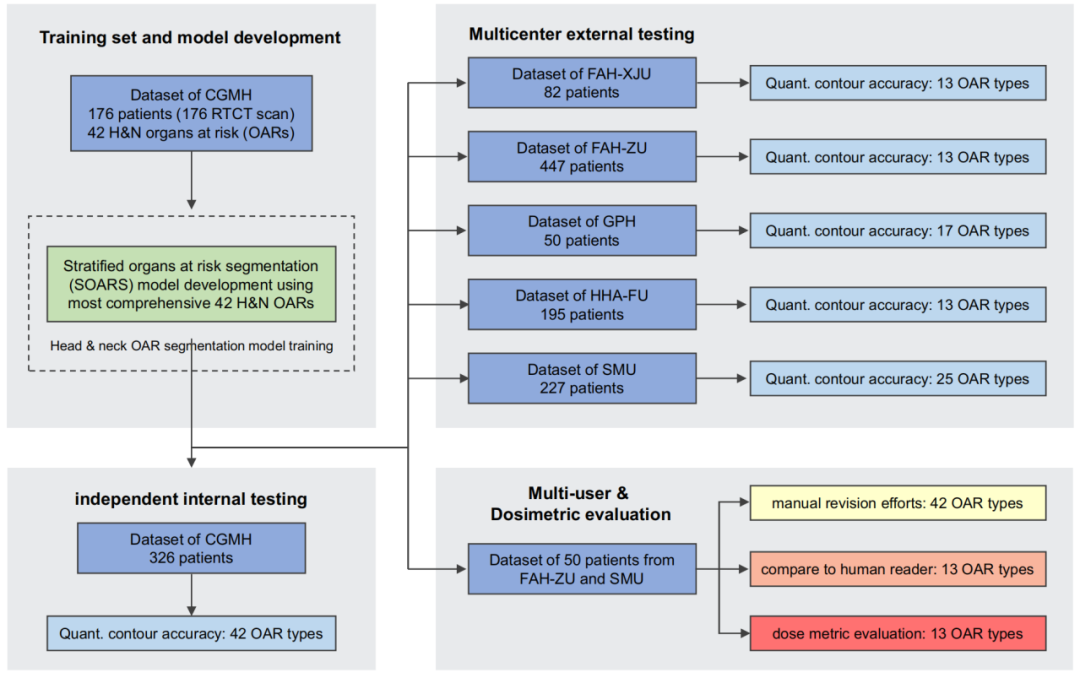
研究流程图
第一步为独立内部测试数据集。与培训验证数据集的来源一致,另326名头颈部肿瘤患者也是从长庚医院收集来的,研究者首先采用这些患者的数据来测试算法系统SOARS。
定量比较结果显示,在42个OARs中,SOARS的平均Dice系数(DSC)达到74.8%,Hausdorff距离(HD)为7.9mm,平均表面距离为1.2mm。
与当时最先进的头颈部OAR分割法UaNet相比,本研究最新开发的算法系统SOARS有着明显的优势,尤其是在S&H OAR中差异最大。事实上,UaNet缺乏专门的分层学习系统来处理更多的OAR;而相比之下,SOARS采用了特有的处理工作流程和优化的网络架构,能够适应特定类别的OAR,自然有着更高的分割准确率。
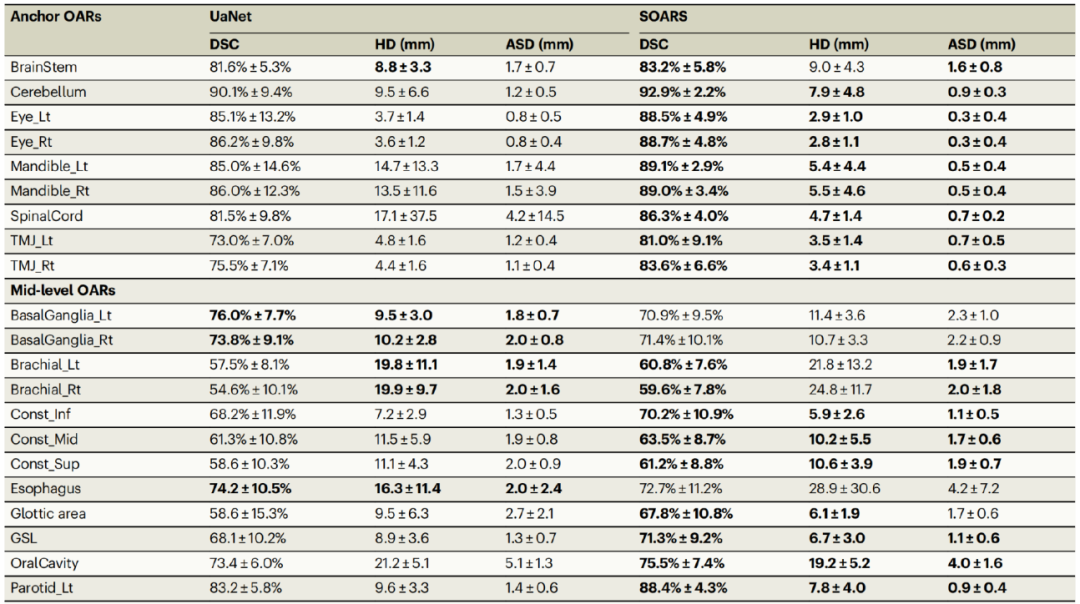
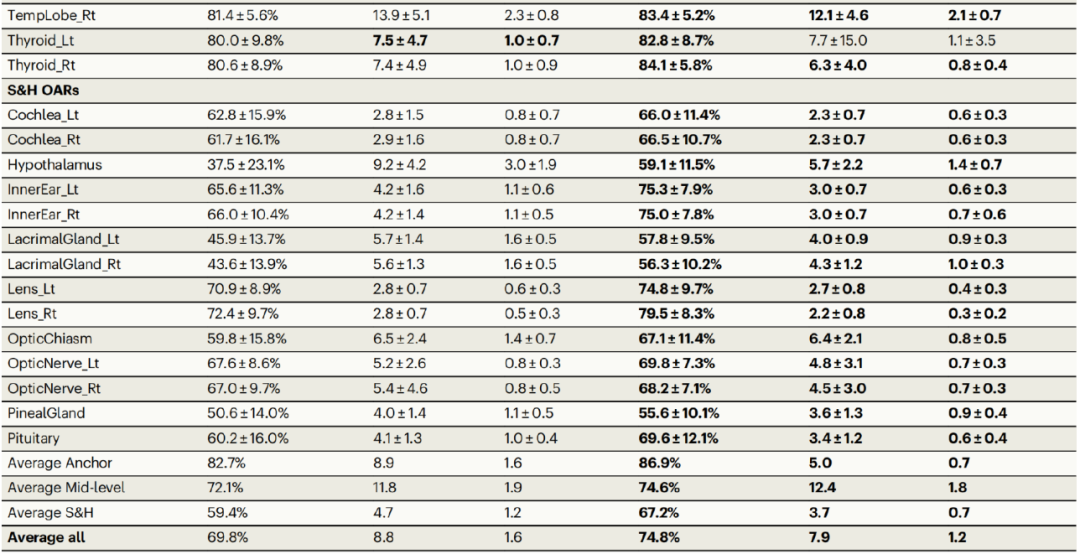
326名患者的独立内部测试的定量比较结果
第二步是多机构外部测试数据集,即从中国不同地区的其他5个医疗机构收集到1001名患者的数据进行测试。为了确保不同机构之间参考OAR轮廓的准确性和一致性,研究者还邀请到高级医生对上述数据进行了深入的检查。
对整体的多机构外部数据进行评估后发现,在25个头颈部OARs中,算法系统SOARS的平均DSC、HD和ASD分别为78.0%、6.7mm和1.0mm。同样,与UaNet相比,SOARS的性能有明显的提高,25个OAR中有21个都优于前者。
由于各个医疗机构的具体RT治疗方案不同,外部机构的OAR数值也各不相同。但计算得到的这些定量性能指标与内部测试的水平基本相当,可见在大规模外部数据上SOARS依然保持着良好的通用性和准确性。
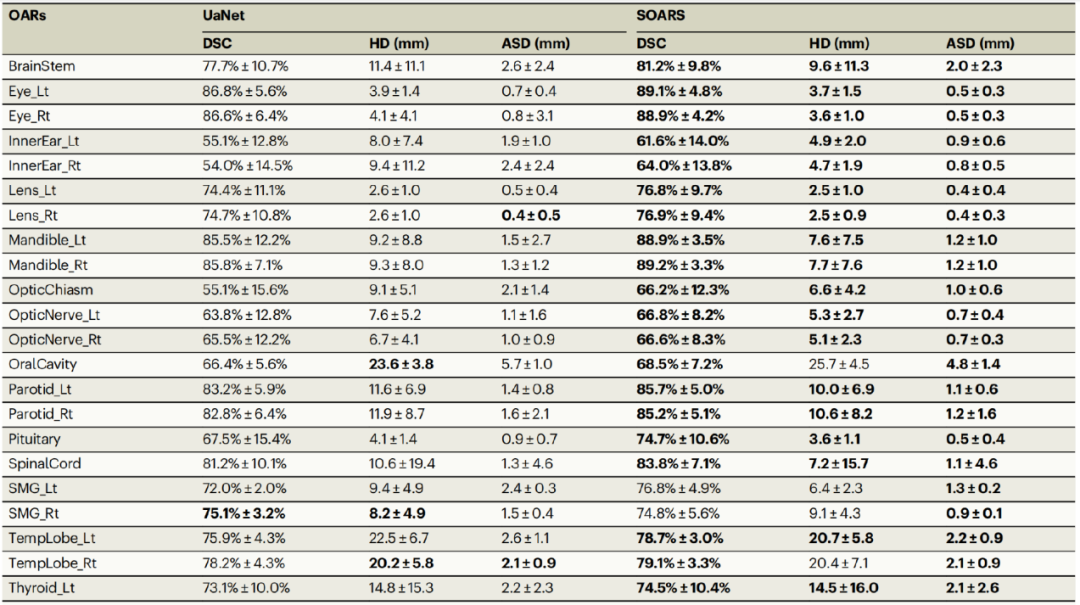
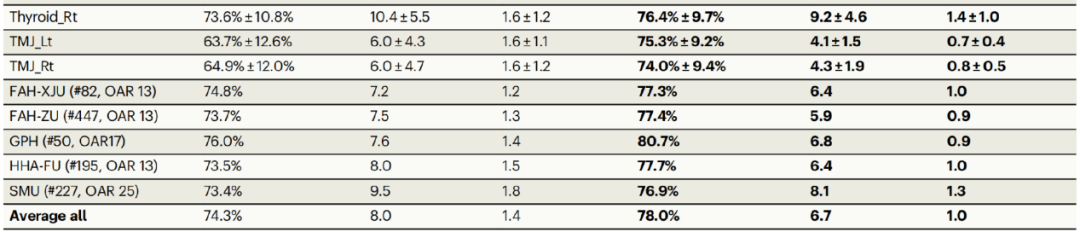
1001名患者的外部测试数据集的定量比较结果
第三步,为了进一步展示SOARS的性能,研究者还评估了两个公共的头颈部OAR数据集——MICCAI和StructSeg 2019。
MICCAI 2015数据集从北美招募了33名培训和15名测试患者,考虑了9个头颈部OARs;StructSeg 2019数据集则从中国大陆招募了50名培训和15名测试患者,检查了22个头颈部OARs。
结果并不令人意外,SOARS依然表现出非常高的准确性。当将SOARS算法系统直接运用于 MICCAI 2015数据集时,9个头颈部OARs中的平均DSC达到80.4%,高于最近提出的绝大多数算法。当使用MICCAI 2015训练集重新对SOARS进行训练后,平均DSC甚至提高到83.6%,遥遥领先于UaNet。类似的结果也出现在StructSeg 2019数据集中。
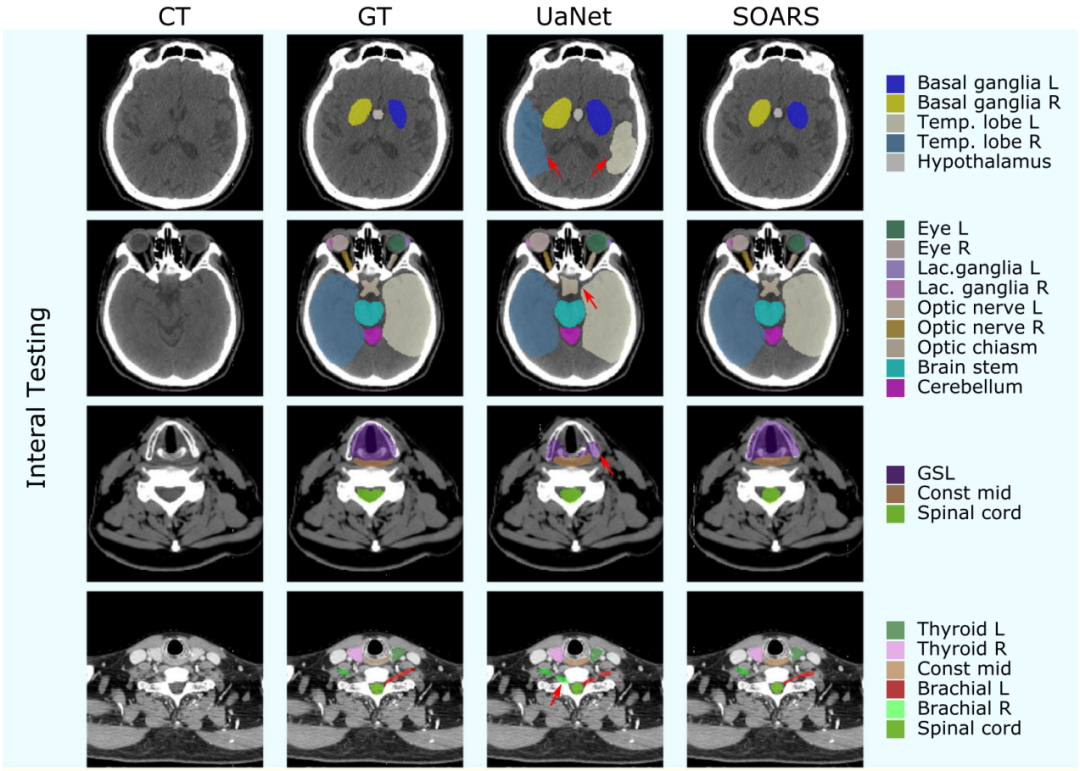
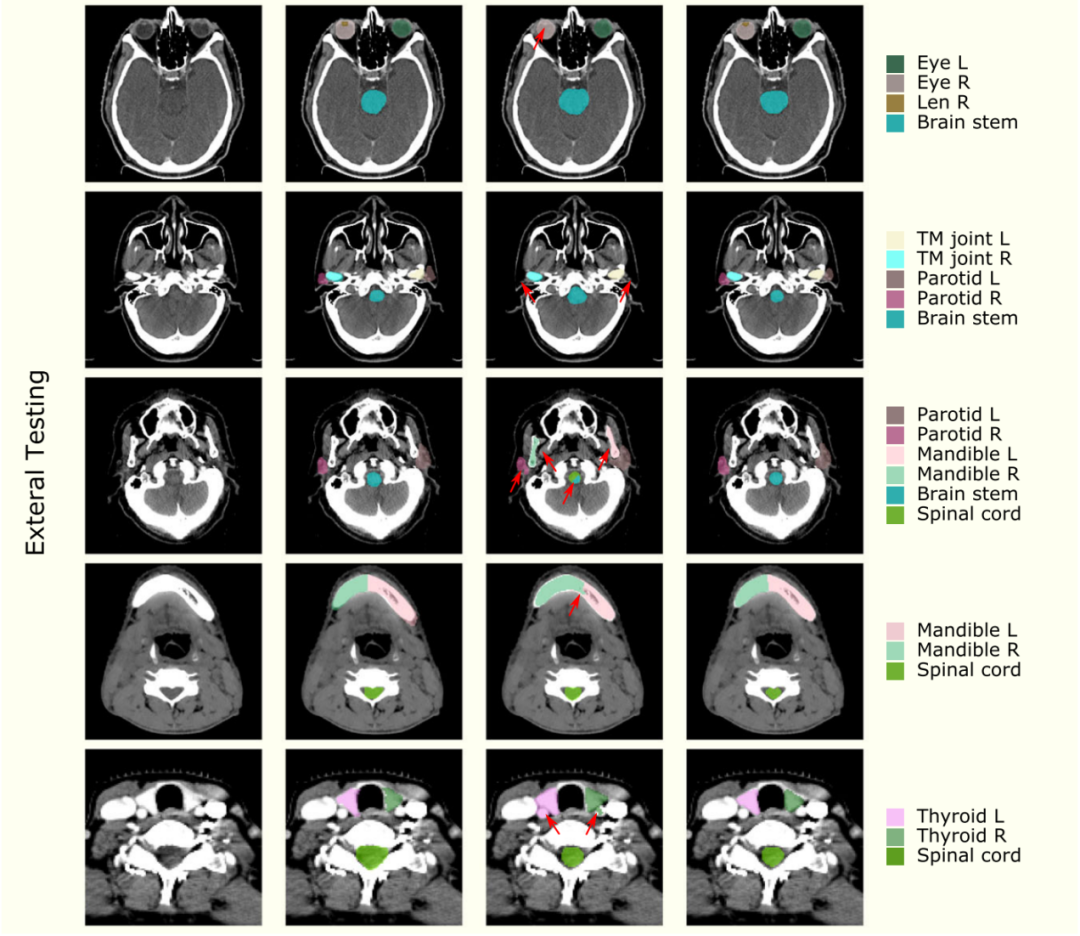
在内部和外部数据集上使用UaNet和SOAR进行定性的OAR分割
最后一步,也是非常关键的一步,为多用户测试数据集。研究者从2个外部机构随机选择了50名鼻咽癌(NPC)患者,形成了一个多用户测试的队列,来评估SOARS的临床适用性。
令人惊喜的是,SOARS产生的98%OAR在临床上可接受或仅需非常小的修订;仅有2%存在自动划线或轮廓错误,需要进行1-3分钟的轻微修改。一般来说,最需要修改的OAR类型为下丘脑、视交叉、食道、口腔、下颌下腺和颞叶。
具体来说,采用SOARS算法系统时,每位患者的42个OARs的平均编辑时间为10.3分钟。而相比之下,如果高级医生仅用纯手工进行标注,每名患者耗费的时间将延长到10.6.4分钟。
因此,在临床实践中,算法系统SOARS能够显著减少医生的工作量。当基于SOARS预测的数据进行编辑,确定42个OARs的时间将显著减少90%!
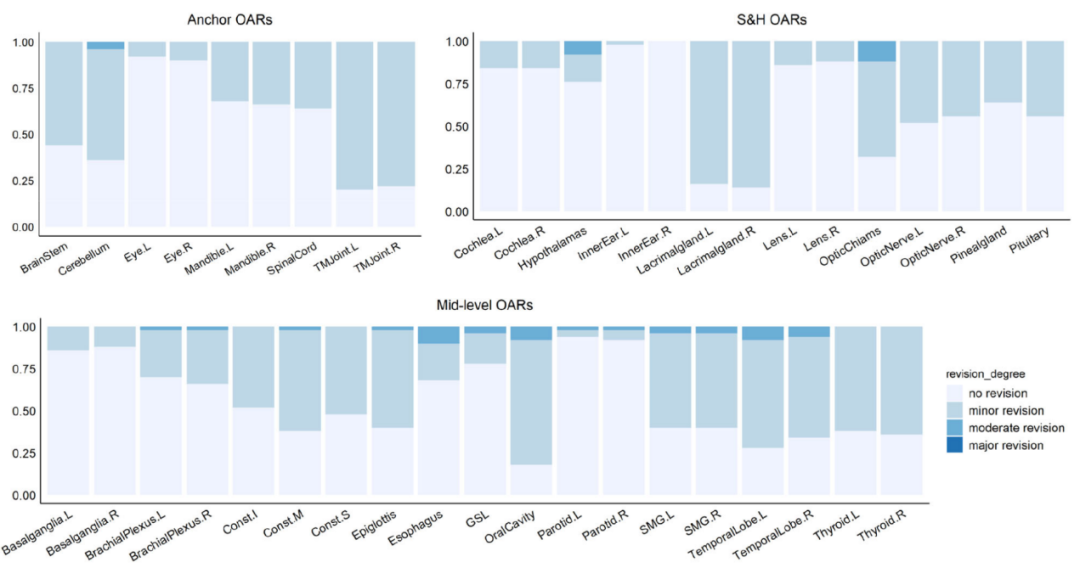
专家采用SOARS预测50名患者的42个OARs
当然,除了节省时间之外,SOARS算法系统的准确性也毋庸置疑,包括轮廓精度的准确性和剂量测量的准确性。
与专业医生手动录入相比,SOARS在全部的13个OARs的轮廓绘制中保持着较高的性能。具体的定量分析显示,算法系统SOARS在平均DSC、HD和ASD三个方面均比人工有着明显的改善,证明SOARS能够“替代”人类专家勾画出高质量的OARs,后续仅需少量的人工确认即可。
确认了轮廓精度后,研究者进一步证明了SOARS的直接和临床剂量测量的准确性。在50名患者的13个OARs中,SOARS预测得到的平均剂量和最大剂量的直接剂量测定差异分别为4.2%和3.3%。统计学上来看,该差异的数值明显小于专业医生人工计算得到的6.0%和4.4%。
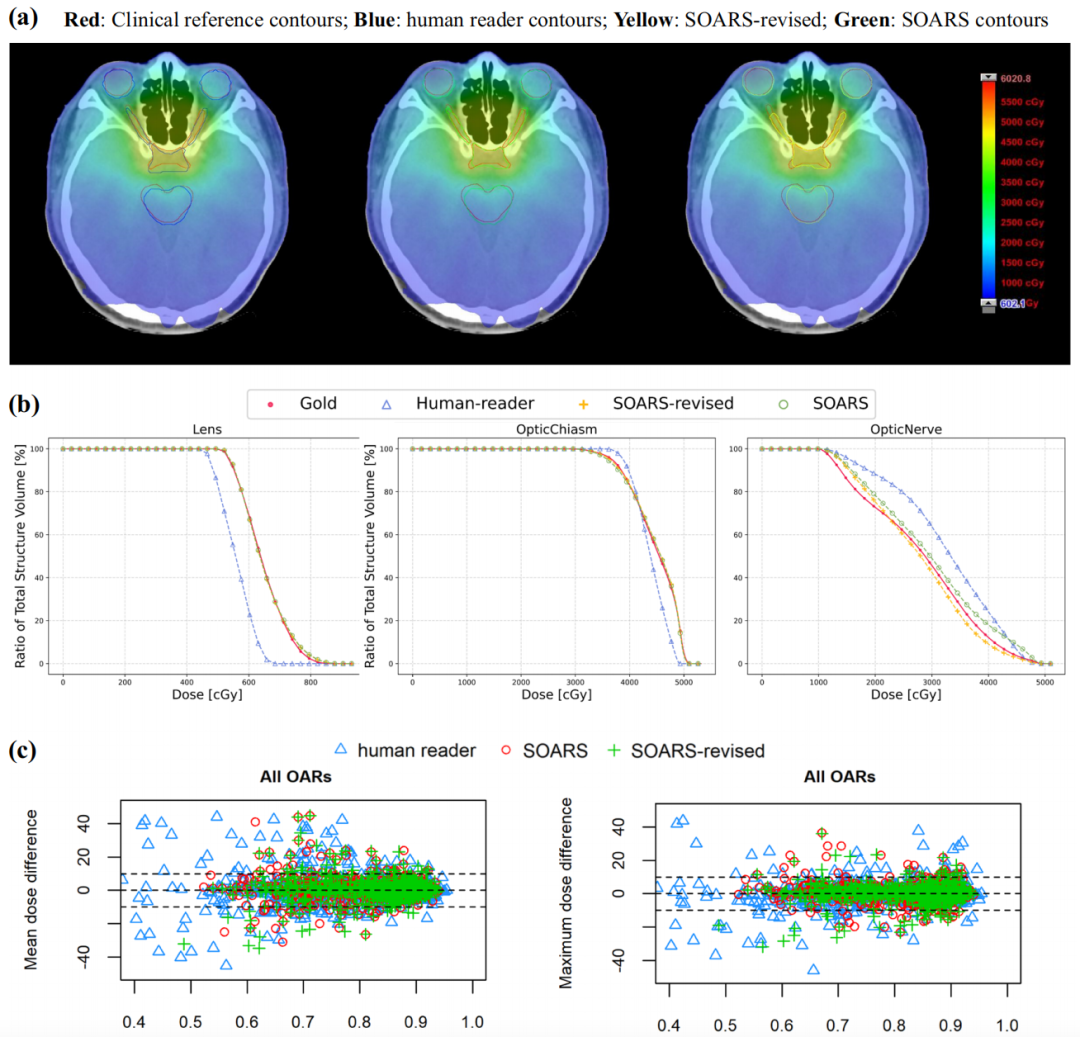
OAR剂量学图
在梅斯医学看来,该项研究至少有3个方面的临床价值:省时、方便研究和教学及促进精准医疗。
首先,该研究为头颈部肿瘤患者提供了一种更精准、更安全、更高效的放射治疗方案。通过使用SOARS算法系统,医生可以自动分割出42个头颈部危及器官(与国际上现有的最好的分割算法相比,SOARS得到的结果提高了至少3-5%),最大限度地保护正常组织,减少辐射剂量和并发症,提高治疗效果和生存质量。这对于头颈部肿瘤患者来说是一项福音,也为放射肿瘤学的发展带来了新的可能性。
其次,它也为头颈部肿瘤的研究和教育提供了一种更便捷、标准的工具。通过使用SOARS算法系统,研究者可以快速地获取大量的高质量的头颈部OARs的数据,用于进行各种临床试验、流行病学分析等。同时,它也可以作为一种教学辅助,帮助医学生和住院医师学习和掌握头颈部OARs的划定方法和技巧。
最后,它还为头颈部肿瘤的个体化和精准医疗提供了支持。通过使用SOARS算法系统,医生可以根据每个患者的具体情况,用更少的时间和更低的成本,调整、优化放疗的参数,实现最佳的疗效和最小的副作用,从而使精准医疗真正成为可能。
达摩院医疗AI团队负责人、IEEE fellow吕乐表示,该算法展示出极大的器官分割性能与可扩展性。未来,不同科室也可根据各自的需求去定制模型。
撰文 | Swagpp
编辑 | Swagpp

 点击下方「阅读原文」 立刻下载梅斯医学APP!
点击下方「阅读原文」 立刻下载梅斯医学APP!


发评论,每天都得现金奖励!超多礼品等你来拿
登录 后,在评论区留言并审核通过后,即可获得现金奖励,奖励规则可见: 查看奖励规则